1. 疾患概念
2012年に改訂されたChapel Hill分類1)では、小血管(毛細血管、細小動・静脈)を主体とした壊死性血管炎のうち血管壁への免疫複合体沈着がほとんどなく(pauci-immune型)、自己抗体である抗好中球細胞質抗体(anti-neutrophil cytoplasmic antibody: ANCA)の陽性率が高い一群をANCA関連血管炎と定義している。さらに、ANCA関連血管炎の中でも多発血管炎性肉芽腫症(旧称ウェゲナー肉芽腫症)は、病理組織学的に(1)全身の壊死性肉芽腫性血管炎、(2)上気道と肺を主とする壊死性肉芽腫性炎、(3)半月体形成腎炎を特徴とする。生命予後不良の疾患であるが、発症早期に免疫抑制療法を開始すると高率に寛解を導入できる。但し、再燃がしばしばみられ問題となる。早期診断にANCAの測定は極めて有用である。多発血管炎性肉芽腫症で認められるANCAのサブタイプは、欧米ではほとんどがproteinase 3に対する抗体(PR3-ANCA)である。一方、わが国ではミエロペルオキシダーゼに対する抗体(MPO-ANCA)が約半数を占める。
2. 疫学
難治性血管炎に関する調査研究班の新規発症患者コホートでは、女性が62.8%とやや多く、発症時の年齢は中央値64才と高齢者に多い疾患である。本邦の年間発症率は宮崎県で行われたpopulation based studyで百万人あたり2人2)、ドイツでは百万人あたり12人、英国では百万人あたり14人と報告されており、欧米と比べて著しく低くなっている。本邦での受給者数は3537人である(令和5年)。
3. 病態生理
上気道の細菌感染を誘因として発症することや,細菌感染により再発がみられることから,スーパー抗原の関与も推定されるが,真の原因は不明である。欧米ではHLA-DPB1*04:01をもつ人に発症しやすいことが報告されている。日本人ではDPB1*04:01の頻度が低いものの、PR3-ANCA陽性群では欧米同様、増加傾向が報告されているが、今後の確認が必要である。自己抗体であるANCAが高率に検出されることから、背景に自己免疫異常が存在すると考えられる。ANCAは動物モデルで血管炎を惹起する病原性を持った自己抗体であることが確認されており、ヒトでもANCAの値と疾患活動性の相関が知られている。近年では、好中球細胞死の形態である好中球細胞外トラップ(NETs)の制御異常や補体第2経路の異常がANCA関連血管炎の病態形成に関与することが報告されている。
4. 症状
発熱,体重減少などの全身症状とともに,(1)上気道の症状:膿性鼻漏,鼻出血,鞍鼻,中耳炎,視力低下,咽喉頭潰瘍など,(2)肺症状:血痰,呼吸困難など,(3)急速進行性腎炎,(4)その他:紫斑,多発関節痛,多発神経炎など、が生じる。症状は通常(1)→(2)→(3)の順序で起こるとされており,(1),(2),(3)のすべての症状が揃っているとき全身型,いずれか二つの症状のみのとき限局型とする。
5. 検査
診断には組織生検が重要であり、副鼻腔、肺、腎臓など生検可能な臓器における早期の病理診断が重要である。主要な組織所見は、①上気道、肺、腎の巨細胞を伴う壊死性肉芽腫性血管炎、②免疫グロブリン沈着を伴わない壊死性半月体形成性糸球体腎炎、③小・細動脈の壊死性肉芽腫性血管炎、である。ANCA(特にPR3-ANCA)は診断および疾患活動性評価の補助となる検査である。しかし、ANCA陰性での再燃や無症状でのANCA持続高値なども時に認めるため、ANCAの値の推移のみを指標として治療を行うことは推奨されていない。
6. 診断
表1に示す診断基準により、確実(definite)、疑い(probable)と判定する。なお、本疾患は厚生労働省の指定難病に指定されており、難病情報センターに詳細な記載がある(https://www.nanbyou.or.jp/entry/4011)。
7. 治療
- ANCA関連血管炎の診療ガイドライン(厚生労働科学研究費補助金難治性疾患政策研究事業、2023年)を参考にする。
- 可能であれば組織生検により血管炎を証明し、可及的早期に確定診断し、迅速に寛解導入療法を開始することが長期的予後を改善する上で重要である。
- 寛解導入療法により一旦寛解導入されたら(治療開始から6ヶ月が目安)、再燃抑制を目的に長期の維持療法を行う(2年〜4年)。
- 最重症の糸球体腎炎症例には血漿交換療法を併用する。
- 再燃時には寛解導入療法に準じて治療を行う。
- 細菌感染症・日和見感染症対策を十分に行う。
1) 治療指針
① 寛解導入療法
疾患活動性評価、治療強度の選択には、専門的知識と経験が必要であり、顕微鏡的多発血管炎あるいはANCA関連血管炎を疑われた場合には、まず専門医を受診することが最も重要である。
寛解導入療法の第一選択はグルココルチコイド(副腎皮質ステロイド)+リツキシマブもしくはシクロホスファミドの併用療法が推奨されている。グルココルチコイドの投与量は、従来の大量投与よりもPEXIVAS試験4)(プレドニン換算60mg/日で開始し、15週で5mg/日まで減量)やLoVAS試験5)(プレドニン換算0.5mg/kg/日で開始し、5ヶ月で投与終了)で用いられた減量レジメンが推奨されている。あるいは、リツキシマブもしくはシクロホスファミドに加えアバコパンを用いることで、グルココルチコイドの投与量を抑えてもよい。
ステロイドパルス療法は重症の血管炎、特に急速進行性糸球体腎炎(RPGN)を呈した際にしばしば用いられる。最重症の腎障害(≧Cr5.6mg/dl)を認める場合は血漿交換療法を追加併用する。リツキシマブ、シクロホスファミドともに使用できない場合はメトトレキサート(保険適応外)およびミコフェノール酸モフェチルが代わりの選択肢となる。
② 寛解維持療法
寛解達成後にそれを維持することがAAV患者の長期予後改善につながる。寛解維持療法の第一選択薬はリツキシマブ(500mg/半年毎などいくつかのレジメンが存在する)であり、これを2〜4年継続する。患者の症状やANCAの値に応じて、少量のグルココルチコイドが併用される場合もある。リツキシマブが使用できない場合は、アザチオプリン、メトトレキサート(保険適応外)、ミコフェノール酸モフェチルが代わりの選択肢となる。
(2)合併症の予防と治療
感染症の予防、グルココルチコイドの副作用の評価と対応が特に重要である。強力な免疫抑制治療中は、ニューモシスチス肺炎に対する予防投与を行う。体重管理、糖尿病、高脂血症、高血圧、骨粗鬆症、白内障、緑内障等のフォローを確実に行い、新型コロナワクチン、インフルエンザワクチン、肺炎球菌ワクチン、帯状疱疹ワクチンは可能な限り接種する。規則正しい食事、適切なカロリー摂取、カルシウム摂取を指導する。
8. 予後
我が国のコホート研究に登録された新規患者33名の6か月後の寛解導入率は97%であった。一般に,副腎皮質ステロイドの副作用軽減のためには速やかな減量が必要である。一方で、減量速度が速すぎると再燃の頻度が高くなる。疾患活動性の指標として臨床症状,尿所見,PR3-ANCAおよびCRPなどが参考となる。進行例では免疫抑制療法の効果が乏しく,腎不全により透析導入となったり,慢性呼吸不全に陥る場合がある。死因は敗血症や肺感染症が多い。また,全身症状の寛解後に著明な鞍鼻や視力障害を後遺症として残す例がある。
参考文献
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013;65:1-11.
- Fujimoto S, Watts RA, Kobayashi S, et al. Comparison of the epidemiology of anti-neutrophil cytoplasmic antibody-associated vasculitis between Japan and the U.K. Rheumatology (Oxford) 2011;50:1916
- Tsuchiya N, Kobayashi S, Kawasaki A, et al. Genetic background of Japanese patients with antineutrophil cytoplasmic antibody-associated vasculitis: association of HLA-DRB1*0901 with microscopic polyangiitis. J Rheumatol. 2003 Jul;30(7):1534-40.
- Walsh M, Merkel PA, Peh CA, et al. Plasma Exchange and Glucocorticoids in Severe ANCA-Associated Vasculitis. N Engl J Med. 2020 Feb 13;382(7):622-631.
- Furuta S, Nakagomi D, Kobayashi Y, et al. Effect of Reduced-Dose vs High-Dose Glucocorticoids Added to Rituximab on Remission Induction in ANCA-Associated Vasculitis: A Randomized Clinical Trial. JAMA. 2021 Jun 1;325(21):2178-2187.
表1.多発血管炎性肉芽腫症の診断基準
1.主要症状
(1)上気道(E)の症状
E:鼻(膿性鼻漏,出血,鞍鼻),眼(眼痛,視力低下,眼球突出),耳(中耳炎),口腔・咽頭痛(潰瘍,嗄声,気道閉塞)
(2)肺(L)の症状
L:血痰,咳嗽,呼吸困難
(3)腎(K)の症状
血尿,蛋白尿,急速に進行する腎不全,浮腫,高血圧
(4)血管炎による症状
① 全身症状:発熱(38℃以上,2 週間以上),体重減少(6 カ月以内に6 ㎏以上)
② 臓器症状:紫斑,多関節炎(痛),上強膜炎,多発性神経炎,虚血性心疾患(狭心症・心筋梗塞),消化管出血(吐血・下血),胸膜炎
2.主要組織所見
① E,L,Kの巨細胞を伴う壊死性肉芽腫性炎
② 免疫グロブリン沈着を伴わない壊死性半月体形成腎炎
③ 小細動脈の壊死性肉芽腫性血管炎
3. 主要検査所見
Proteinase 3-ANCA(PR3-ANCA)(蛍光抗体法でcytoplasmic pattern,C-ANCA)が高率に陽性を示す。
4. 判定
(1)確実(definite)
(a)上気道(E),肺(L),腎(K)のそれぞれ1臓器症状を含め主要症状の3項目以上を示す例
(b)上気道(E),肺(L),腎(K),血管炎による主要症状の2項目以上及び,組織所見①,②,③の1項目以上を示す例
(c)上気道(E),肺(L),腎(K),血管炎による主要症状の1項目以上と組織所見①,②,③の1項目以上及びC(PR-3) ANCA 陽性の例
(2)疑い(probable)
(a)上気道(E),肺(L),腎(K),血管炎による主要症状のうち2項目以上の症状を示す例
(b)上気道(E),肺(L),腎(K),血管炎による主要症状のいずれか1項目及び,組織所見①,②,③の1項目を示す例
(c)上気道(E),肺(L),腎(K),血管炎による主要症状のいずれか1項目とC(PR-3)ANCA 陽性を示す例
5. 参考となる検査所見
① 白血球,CRPの上昇
② BUN,血清クレアチニンの上昇
6. 識別診断
① E,Lの他の原因による肉芽腫性疾患(サルコイドーシスなど)
② 他の血管炎症候群 (顕微鏡的多発血管炎,好酸球性多発血管炎性肉芽腫症(チャーグ・ストラウス症候群),結節性多発動脈炎、抗糸球体基底膜腎炎(グッドパスチャー症候群) など)
7. 参考事項
①上気道(E),肺(L),腎(K)のすべてがそろっている例は全身型,上気道(E),下気道(L),のうち単数もしくは2つの臓器にとどまる例を限局型と呼ぶ。
② 全身型はE,L,Kの順に症状が発現することが多い。
③ 発症後しばらくすると,E,Lの病変に黄色ぶどう球菌を主とする感染症を合併しやすい。
④ E,Lの肉芽腫による占拠性病変の診断にCT,MRIが有用である。
⑤ PR3-ANCAの力価は疾患活動性と平行しやすい。日本では多発血管炎性肉芽腫症の患者の半数はMPO-ANCA陽性である。
重症度分類
多発血管炎性肉芽腫症による以下のいずれかの臓器障害を有する場合を重症(難病の医療費助成の対象)とする。
| 臓器 | 障害の内容 |
|---|---|
| 腎臓 | ①又は②を満たす場合 ①CKD重症度分類ヒートマップの赤色に該当*1 ②いずれの腎機能であっても尿蛋白 0.5g/日以上又は 0.5g/gCr 以上 |
| 肺 | 特発性間質性肺炎の重症度分類でIII度以上に該当*2、または肺胞出血 |
| 心臓 | NYHA2度以上の心不全徴候*3 |
| 眼 | 良好な方の眼の矯正視力が0.3未満 |
| 耳 | 両耳の聴力レベルが70デシベル以上か、一側耳の聴力が90デシベル以上かつ他側耳の聴力レベルが50デシベル以上の聴力障害 |
| 平衡機能の著しい障害または極めて著しい障害*4 | |
| 腸管 | 腸管梗塞、消化管出血 |
| 皮膚・軟部組織 | 四肢の梗塞・潰瘍・壊疽、またはそれらによる四肢の欠損・切断(部位は問わない) |
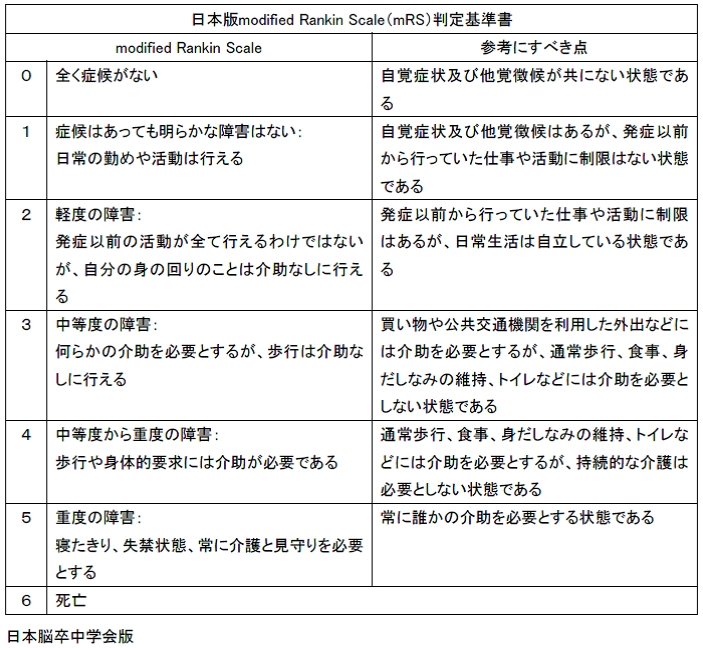
| 神経 | 脳血管障害により、modified Rankin Scaleで3以上*5 |
| 末梢神経障害により、徒手筋力テストで筋力3以下*6 | |
| 末梢神経障害による2肢以上の知覚異常 | |
| 肥厚性硬膜炎 |
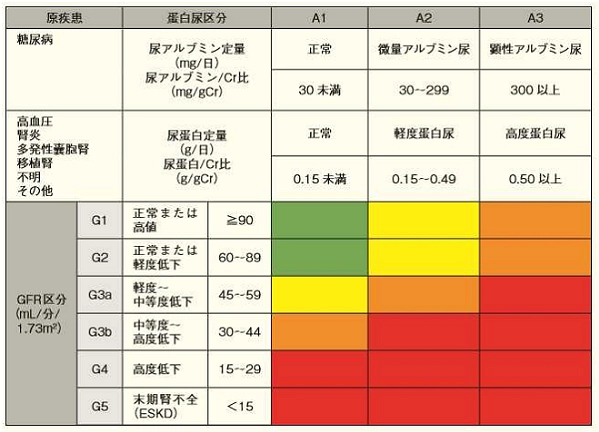
*1 慢性腎臓病重症度分類
画像クリックで拡大できます。
*2 特発性間質性肺炎の重症度分類
| 重症度分類 | 安静時動脈血酸素分圧 | 6分間歩行時 最低SpO2 |
|---|---|---|
| I | 80Torr以上 | 90 %未満の場合はIIIにする |
| II | 70Torr以上 80Torr未満 | 90 %未満の場合はIIIにする |
| III | 60Torr以上 70Torr未満 | 90 %未満の場合はIVにする (危険な場合は測定不要) |
| IV | 60Torr未満 | 測定不要 |
上記の重症度分類でIII度以上を重症とする。安静時動脈血酸素分圧でIII度以上の条件を満たせば6分間歩行は実施しなくても良い。
*3 NYHA心機能分類
| クラス | 自覚症状 |
|---|---|
| I | 身体活動を制限する必要はない心疾患患者。通常の身体活動で、疲労、動悸、息切れ、狭心症状が起こらない。 |
| II | 身体活動を軽度ないし中等度に制限する必要のある心疾患患者。通常の身体活動で、疲労、動悸、息切れ、狭心症状が起こる。 |
| III | 身体活動を高度に制限する必要のある心疾患患者。安静時には何の愁訴もないが、普通以下の身体活動でも疲労、動悸、息切れ、狭心症状が起こる。 |
| IV | 身体活動の大部分を制限せざるを得ない心疾患患者。安静時にしていても心不全症状や狭心症状が起こり、少しでも身体活動を行うと症状が増悪する。 |
上記分類でII度以上を重症とする。
*4 身体障害認定の平衡機能障害
ア 「平衡機能の極めて著しい障害」(3級)とは、四肢体幹に器質的異常がなく、他覚的に平衡機能障害を認め、閉眼にて起立不能、又は開眼で直線を歩行中 10m以内に転倒若しくは著しくよろめいて歩行を中断せざるを得ないものをいう。
イ 「平衡機能の著しい障害」(5級)とは、閉眼で直線を歩行中 10m以内に転倒又は著しくよろめいて歩行を中断せざるを得ないものをいう。
ウ 平衡機能障害の具体的な例は次のとおりである。
- 末梢迷路性平衡失調
- 後迷路性及び小脳性平衡失調
- 外傷又は薬物による平衡失調
- 中枢性平衡失調
上記分類で、「平衡機能の著しい障害」、「平衡機能の極めて著しい障害」相当の障害を重症とする。
*5 modified Rankin Scale
画像クリックで拡大できます。
上記スケールで3以上を重症とする。
*6 徒手筋力テスト
| 0 | 筋肉の収縮が観察できない |
|---|---|
| 1 | 筋肉の収縮は観察できるが関節運動ができない |
| 2 | 運動可能であるが重力に抗した動きはできない |
| 3 | 重力に抗した運動が可能だが極めて弱い |
| 4 | 3と5の中間。重力に抗した運動が可能で中等度の筋力低下 |
| 5 | 正常筋力 |
上記スケールで3以下を重症とする。